Déjate sorprender: Descubre cuántos orbitales tiene el subnivel d de manera rápida y sencilla
Los átomos consisten en un núcleo que está rodeado por electrones distribuidos en diferentes niveles y subniveles. Estos electrones se encuentran en órbitas alrededor del núcleo, y cada órbita puede contener un número máximo de electrones. Cada nivel se divide en subniveles, y uno de ellos es el subnivel d.
En este artículo veremos cuántos orbitales tiene el subnivel d y cómo podemos determinarlo fácilmente. Exploraremos la configuración electrónica y las reglas que rigen la distribución de los electrones en el subnivel d. También discutiremos ejemplos específicos para comprender mejor cómo funciona esto en la práctica. Si estás interesado en aprender más sobre la estructura de los átomos y los electrones, sigue leyendo y descubre cuántos orbitales tiene el subnivel d.
- Aquí tienes la lista de temas para tu artículo web:
- Qué son los orbitales en química y por qué son importantes
- ¿Qué es un subnivel d y cómo se relaciona con los orbitales?
- ¿Cuántos orbitales tiene el subnivel d?
- Cuáles son los subniveles de energía en los átomos
- Qué diferencia hay entre el subnivel s y el subnivel d
- Cuántos orbitales tiene el subnivel d y cuál es su notación
- Cómo se distribuyen los electrones en los orbitales del subnivel d
- Cuál es la relación entre los electrones y los orbitales en el subnivel d
- Cuál es la regla de Hund y cómo se aplica en el subnivel d
- Qué ejemplos de elementos contienen orbitales d en su configuración electrónica
- Cuál es la importancia de entender los orbitales d en la química y la física
-
Preguntas frecuentes (FAQ)
- 1. ¿Cuántos orbitales tiene el subnivel d?
- 2. ¿Cuál es la capacidad máxima de electrones en el subnivel d?
- 3. ¿En qué grupos de la tabla periódica encontramos elementos con electrones en el subnivel d?
- 4. ¿Cómo se distribuyen los electrones en los orbitales del subnivel d?
- 5. ¿Qué importancia tienen los electrones en el subnivel d para las propiedades químicas de los elementos?
Aquí tienes la lista de temas para tu artículo web:
¿Qué son los orbitales?
Antes de profundizar en los detalles del subnivel d, es importante entender qué son los orbitales. En química, los orbitales son regiones del espacio alrededor del núcleo de un átomo donde es más probable encontrar electrones. Los electrones se distribuyen en estos orbitales de acuerdo con ciertas reglas y principios, lo que determina las propiedades químicas de los elementos.
Los subniveles y su importancia
Los subniveles son subdivisiones de los niveles principales de energía de un átomo. Estos subniveles indican la forma y orientación espacial de los orbitales en un nivel energético dado. Los subniveles se representan con letras: s, p, d, y f. Cada subnivel tiene un número definido de orbitales que pueden alojar un máximo de dos electrones cada uno.
Estructura del subnivel d
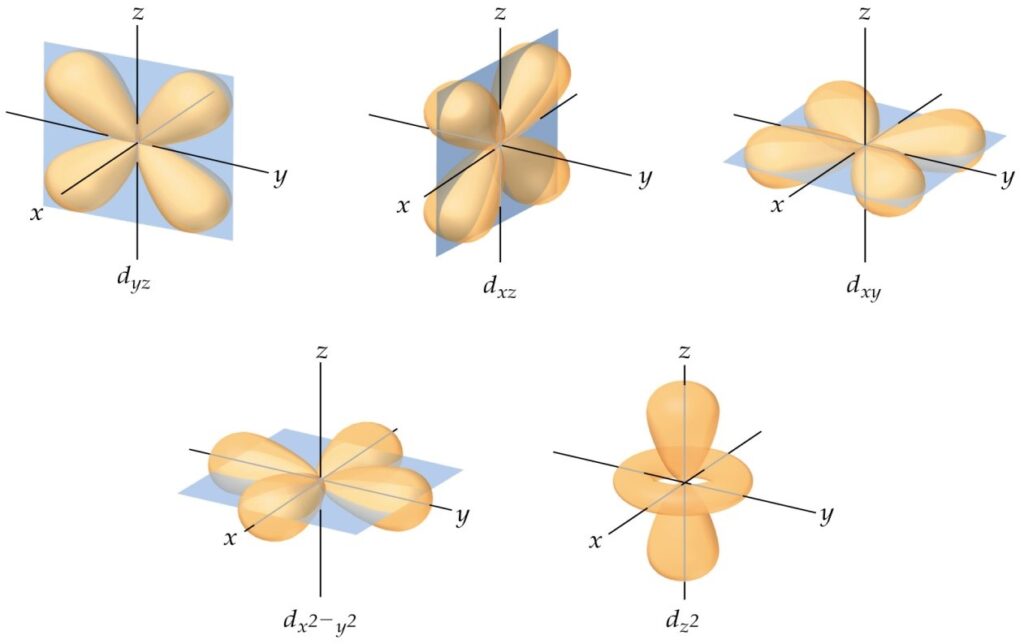
El subnivel d es el tercer subnivel del nivel principal de energía. Se encuentra por debajo del subnivel p y puede contener hasta 10 electrones distribuidos en 5 orbitales. Estos orbitales tienen una forma compleja y varían en su orientación espacial. La notación de los orbitales d es dxz, dyz, dxy, dx²-y², y dz².
La forma de los orbitales d se asemeja a un doble toroide o una flor de loto, y están compuestos por dos nodos. Los cinco orbitales d están orientados en diferentes direcciones y poseen distintos momentos angulares.
Método para determinar el número de orbitales d
Ahora que conoces la estructura del subnivel d, podemos pasar a determinar cuántos orbitales tiene. Para ello, puedes seguir los siguientes pasos:
- Identifica el nivel principal de energía al que pertenece el subnivel d.
- Verifica que sea un subnivel d válido según su posición en la tabla periódica.
- Determina el número máximo de electrones que puede alojar el subnivel d (en este caso, 10).
- Divide el número máximo de electrones por 2, ya que cada orbital puede alojar como máximo 2 electrones.
- El resultado obtenido será el número de orbitales d.
Recuerda que esta es una forma rápida y sencilla de determinar el número de orbitales d para cualquier átomo en el nivel principal de energía correspondiente.
Qué son los orbitales en química y por qué son importantes
Los orbitales en química son regiones del espacio alrededor del núcleo atómico donde hay una alta probabilidad de encontrar electrones. En otras palabras, son como "nubes" donde los electrones se encuentran ubicados. Estos orbitales están cuantizados, lo que significa que solo pueden tener ciertos valores de energía y forma específicos.
La importancia de los orbitales radica en el hecho de que nos ayudan a comprender mejor la estructura electrónica de los átomos y moléculas. La distribución de electrones en los diferentes orbitales determina las propiedades químicas de los elementos y las reacciones químicas que pueden ocurrir.
¿Qué es un subnivel d y cómo se relaciona con los orbitales?
En la notación de configuración electrónica de los átomos, los subniveles son indicadores de la energía y la forma orbital. Los subniveles se denominan con letras: s, p, d, f, g, h, etc. Cada subnivel tiene una forma orbital característica y puede contener diferentes números de orbitales.
En particular, el subnivel d se refiere a aquellos orbitales con forma de doble petalo. Cada orbital d puede alojar hasta 10 electrones. Es importante mencionar que el subnivel d pertenece a los subniveles superiores de energía, siendo posterior al subnivel s y p. Esto implica que el subnivel d aparece a partir del tercer nivel energético (n=3) y se extiende hacia niveles más altos.
La existencia de los orbitales d permite una mayor capacidad de albergar electrones en un átomo o ion. Esto tiene implicaciones en la configuración electrónica de los elementos y puede influir en sus propiedades químicas, como su reactividad o capacidad para formar compuestos.
¿Cuántos orbitales tiene el subnivel d?
El subnivel d puede contener un total de 5 orbitales. Estos orbitales se designan con las letras dxy, dxz, dyz, dx²-y² y dz². Cada uno de estos orbitales tiene una forma particular y alberga hasta 2 electrones, cumpliendo con el principio de exclusión de Pauli.
El subnivel d consta de 5 orbitales diferentes que pueden acomodar hasta un máximo de 10 electrones. Esta información es clave para comprender la estructura electrónica de diversos elementos y su comportamiento químico.
Cuáles son los subniveles de energía en los átomos
Los átomos están compuestos por electrones que giran alrededor del núcleo en diferentes niveles de energía. Estos niveles se conocen como subniveles de energía y son una forma de clasificar los electrones dentro de un átomo.
Existen varios tipos de subniveles de energía, designados por letras: s, p, d, y f. Cada uno de estos subniveles tiene un número específico de orbitales disponibles para acomodar los electrones.
El subnivel d y sus orbitales
Focalizándonos en el subnivel d, este posee un total de cinco orbitales posibles. Estos orbitales se representan como dxy, dyz, dxz, dx²-y², y dz². Cada orbital puede contener hasta dos electrones, siguiendo el principio de exclusión de Pauli.
Es importante destacar que estos orbitales tienen formas distintivas y se distribuyen en diferentes planos alrededor del núcleo atómico. Esta distribución espacial proporciona información valiosa sobre la probabilidad de encontrar un electrón en un área determinada.
La notación de los orbitales d puede parecer confusa al principio, pero es fundamental en la descripción de las propiedades y configuración electrónica de los elementos. A medida que los electrones llenan estos orbitales, siguen un orden de energía creciente.
El orden de llenado de los orbitales d sigue reglas específicas. Primero, se llenan los orbitales dxy, dyz, y dxz, que son los de menor energía. Luego, se procede a llenar los orbitales dx²-y² y dz², que tienen mayor energía.
Recuerda que cada orbital d puede contener hasta dos electrones, lo que significa que el subnivel d puede albergar un total de 10 electrones. Esto se debe a que hay cinco orbitales disponibles, cada uno capaz de alojar una pareja de electrones con espines opuestos.
El subnivel d tiene cinco orbitales: dxy, dyz, dxz, dx²-y², y dz². Estos orbitales pueden contener hasta dos electrones cada uno, lo que resulta en un total de 10 electrones para el subnivel d.
Es crucial comprender la relación entre los subniveles de energía y los orbitales para entender mejor la estructura electrónica de los átomos y sus propiedades químicas. Explorar la configuración electrónica de los elementos es clave para comprender su comportamiento y su papel en muchas reacciones químicas.
Qué diferencia hay entre el subnivel s y el subnivel d
El modelo atómico propuesto por Niels Bohr en 1913 se ha convertido en uno de los fundamentos de la química moderna. Según este modelo, los electrones se encuentran distribuidos alrededor del núcleo atómico en diferentes niveles de energía, que a su vez se dividen en subniveles.
Dentro de estos subniveles, encontramos el subnivel s y el subnivel d, los cuales poseen algunas diferencias importantes. El subnivel s puede tener un máximo de 2 electrones, mientras que el subnivel d puede contener hasta 10 electrones. Además, los orbitales del subnivel s tienen una forma esférica, mientras que los del subnivel d tienen una forma más compleja, conocida como "lóbulos" o "cuatro hojas".
Otra diferencia radica en la energía. Los electrones que ocupan los orbitales del subnivel s tienen menor energía que aquellos en los orbitales del subnivel d. Esto significa que los electrones del subnivel s están más cerca del núcleo atómico y son menos reactivos que los electrones del subnivel d.
¿Cuántos orbitales tiene el subnivel d?
El subnivel d consta de un total de 5 orbitales, cada uno con una orientación espacial específica. Estos orbitales se denominan dz², dxz, dyz, dx²-y² y dxy.
- Orbital dz²: tiene forma de doble plato, con sus lóbulos apuntando hacia arriba y hacia abajo. Su eje z es paralelo al eje de rotación del electrón alrededor del núcleo.
- Orbital dxz: tiene forma de pétalo, con un lóbulo principal apuntando hacia adelante y otro hacia atrás. Su eje x se encuentra en dirección perpendicular al plano xy.
- Orbital dyz: también tiene forma de pétalo, pero con el lóbulo principal apuntando hacia arriba y hacia abajo. Su eje y está en dirección perpendicular al plano xz.
- Orbital dx²-y²: tiene una forma similar a un doble donut o una cruz. Sus dos lóbulos más grandes apuntan a lo largo de los ejes x e y, mientras que los lóbulos más pequeños apuntan diagonalmente.
- Orbital dxy: tiene forma de ocho acostado, con sus lóbulos apuntando a lo largo de las diagonales del plano xy.
El subnivel d consta de 5 orbitales con formas específicas y orientaciones espaciales distintas. Estos orbitales permiten la distribución de hasta 10 electrones en el subnivel d, proporcionando una mayor capacidad de almacenamiento de electrones en comparación con el subnivel s.
Cuántos orbitales tiene el subnivel d y cuál es su notación
El subnivel d es uno de los cinco subniveles que forman parte de la estructura electrónica de los átomos. Este subnivel se encuentra en el tercer nivel de energía, también conocido como nivel n=3. Los otros subniveles son s, p, f y g.
Para determinar cuántos orbitales tiene el subnivel d, utilizamos la siguiente fórmula:
2(2l + 1)
Donde 'l' representa el número cuántico azimutal y puede tener valores desde 0 hasta (n-1). Dado que estamos hablando del subnivel d, tenemos que 'n' es igual a 3, por lo tanto, 'l' puede tener un valor de 0, 1 o 2.
Reemplazando estos valores en la fórmula, obtenemos:
Para l = 0: 2(2(0) + 1) = 2
Para l = 1: 2(2(1) + 1) = 6
Para l = 2: 2(2(2) + 1) = 10
Por lo tanto, el subnivel d tiene un total de 2 + 6 + 10 = 18 orbitales.
Es importante destacar que cada orbital puede albergar un máximo de dos electrones con espines opuestos, según el principio de exclusión de Pauli.
En cuanto a la notación utilizada para representar los orbitales d, se utiliza la letra 'd' seguida de un número romano que indica el valor de 'l'. Así, el primer orbital d se representa como dxy, el segundo como dxz, el tercero como dyz, el cuarto como dz2 y el quinto como dx2-y2.
El subnivel d tiene un total de 18 orbitales y se representa mediante la notación dxy, dxz, dyz, dz2 y dx2-y2.
Cómo se distribuyen los electrones en los orbitales del subnivel d
Para comprender cómo se distribuyen los electrones en los orbitales del subnivel d, primero debemos entender qué son los subniveles y cómo se organizan en la estructura electrónica de un átomo.
Los subniveles son divisiones más pequeñas dentro de los niveles de energía en un átomo. Estos subniveles son representados por las letras s, p, d y f, que indican diferentes formas o configuraciones de los orbitales atómicos donde los electrones pueden encontrarse.
En particular, el subnivel d es uno de estos subniveles, y se encuentra asociado a cinco orbitales d diferentes. Cada uno de estos orbitales puede alojar hasta 2 electrones, según el principio de exclusión de Pauli y el principio de máxima multiplicidad de Hund.
El subnivel d está situado en el tercer nivel de energía principal y se caracteriza por tener una forma más compleja y simétrica que los subniveles anteriores (s y p). Cada uno de los cinco orbitales d tiene una forma similar a una "p" doblada y se les asigna una letra específica: dx2-y2, dz2, dxy, dxz e dyz.
La manera de determinar cuántos electrones pueden ocupar cada orbital es mediante la regla de Aufbau. Esta regla establece que los electrones se llenan en los orbitales disponibles en orden creciente de energía. Es decir, primero se llenan los orbitales de menor energía y luego los de mayor energía.
Por ejemplo, el primer electrón irá al orbital de menor energía (dxy) y, a medida que se añadan más electrones, estos ocuparán los siguientes orbitales en orden creciente de energía.
El subnivel d tiene cinco orbitales diferentes en los cuales los electrones pueden distribuirse. Cada orbital puede alojar hasta 2 electrones. La distribución de los electrones en estos orbitales sigue la regla de Aufbau, donde se llenan en orden creciente de energía.
Cuál es la relación entre los electrones y los orbitales en el subnivel d
El subnivel d es uno de los cuatro subniveles principales que existen en un átomo. Se encuentra dentro del nivel de energía principal 3 y puede contener hasta 10 electrones. Pero, ¿cuántos orbitales tiene exactamente el subnivel d?
Para entender esto, primero necesitamos comprender qué es un orbital. En física cuántica, un orbital es una función matemática que describe la probabilidad de encontrar un electrón en un cierto punto alrededor del núcleo atómico. Los orbitales pueden ser representados como regiones tridimensionales llamadas **nubes electrónicas**.
Los electrones que ocupan el subnivel d se distribuyen en diferentes orbitales. Cada orbital es definido por tres números cuánticos: n, l y m. El número cuántico n representa el nivel de energía principal, l representa el subnivel (0 para s, 1 para p, 2 para d, y así sucesivamente) y m representa la orientación espacial del orbital.
En el caso específico del subnivel d, este puede tener un total de cinco orbitales diferentes, que se representan como dxy, dyz, dxz, dx²-y² y dz². Estos orbitales tienen formas y orientaciones características, lo que indica las direcciones en las que es más probable encontrar un electrón en relación con el núcleo atómico.
Cada uno de estos orbitales puede albergar un máximo de dos electrones con diferentes espines (hacia arriba o hacia abajo). Por lo tanto, sumando todos los electrones que pueden llenar los cinco orbitales d, tenemos un total de 10 electrones.
Es importante mencionar que en el átomo, los electrones tienden a llenar primero los orbitales de menor energía antes de ocupar los de mayor energía. Esto significa que los tres primeros orbitales d (dxy, dyz y dxz) se llenan antes de los dos últimos orbitales (dx²-y² y dz²).
El subnivel d tiene un total de cinco orbitales diferentes (dxy, dyz, dxz, dx²-y² y dz²) que pueden contener hasta 10 electrones en total. Estos orbitales tienen formas y orientaciones características que describen la distribución de probabilidad de encontrar un electrón en el átomo.
Cuál es la regla de Hund y cómo se aplica en el subnivel d
La regla de Hund es una importante regla en la física cuántica que se aplica específicamente al subnivel d. Esta regla se utiliza para determinar la distribución de electrones en los orbitales d y determinar cuántos orbitales hay en total.
Antes de profundizar en la regla de Hund, es útil comprender qué son los orbitales. En el ámbito de la química, los orbitales son regiones del espacio alrededor del núcleo atómico donde es más probable encontrar un electrón. Cada orbital tiene una forma específica y puede contener un máximo de dos electrones con diferentes valores de espín.
El subnivel d es una subcapa dentro de un nivel de energía y está compuesto por cinco orbitales: dxy, dyz, dxz, dx²-y² y dz². Estos orbitales tienen diferentes formas y orientaciones espaciales, lo que significa que los electrones en cada uno de ellos tienen diferentes niveles de energía.
Cuando se aplica la regla de Hund en el subnivel d, se sigue una secuencia específica para llenar los orbitales. La regla establece que los electrones tienden a ocupar todos los orbitales disponibles antes de emparejarse en un mismo orbital. Esto significa que los electrones se distribuirán en los cinco orbitales d de manera que cada uno de ellos tenga al menos un electrón antes de que comiencen a aparearse en el mismo orbital.
La justificación detrás de esta regla es que las interacciones repulsivas entre los electrones se minimizan cuando estos ocupan diferentes orbitales antes de aparearse. Al organizar los electrones de esta manera, se logra un estado de menor energía y, por lo tanto, más estable.
Para ilustrar esto, imaginemos un átomo con un subnivel d que tiene un total de cinco electrones. El primer electrón ocuparía el orbital dxy, el segundo electrón ocuparía el orbital dyz, el tercer electrón ocuparía el orbital dxz, el cuarto electrón ocuparía el orbital dx²-y² y finalmente, el quinto electrón volvería al orbital dxy pero con espín opuesto al primer electrón. De esta manera, todos los orbitales estarían ocupados antes de que cualquier electrón comience a aparearse.
La regla de Hund nos permite determinar cómo se distribuyen los electrones en el subnivel d y cuántos orbitales contiene. Al seguir esta regla, podemos comprender mejor la estructura electrónica de un átomo y predecir su comportamiento químico.
Qué ejemplos de elementos contienen orbitales d en su configuración electrónica
Los orbitales d forman parte de la configuración electrónica de ciertos elementos en la tabla periódica. Dichos elementos pertenecen a los periodos 3, 4, 5 y 6, y específicamente se encuentran en el bloque d de la tabla periódica.
Algunos ejemplos de elementos que contienen orbitales d en su configuración electrónica son:
- Titanio (Ti): La configuración electrónica del titanio es 4s2 3d^2. En este caso, los electrones ocupan los dos subniveles disponibles del orbital d.
- Hierro (Fe): El hierro tiene una configuración electrónica de 4s2 3d^6. En este caso, los seis subniveles del orbital d están completamente llenos.
- Platino (Pt): La configuración electrónica del platino es 6s1 4f14 5d^9. Aquí, los nueve subniveles del orbital d están parcialmente llenos.
Es importante destacar que en cada uno de estos elementos, los electrones pueden tener diferentes niveles de energía y propiedades magnéticas dependiendo de cómo se organicen en los orbitales d. Esta variedad de configuraciones electrónicas permite a los elementos exhibir diferentes comportamientos químicos y físicos.
Para determinar cuántos subniveles se encuentran en el orbital d de un elemento en particular, podemos utilizar la regla de Madelung. Esta regla establece que los subniveles de menor energía se llenan antes y sigue un orden específico de llenado. En el caso de los orbitales d, los electrones se distribuyen de la siguiente manera: 3d^1, 3d^2, 3d^3, ..., 3d^10, 4d^1, 4d^2, y así sucesivamente.
Los elementos que contienen orbitales d en su configuración electrónica presentan una mayor variedad de comportamientos químicos debido a las diferentes formas en que los electrones ocupan estos subniveles. Conocer cuántos subniveles tiene el orbital d de cada elemento nos permite comprender mejor sus propiedades y reactividad química.
Cuál es la importancia de entender los orbitales d en la química y la física
Los orbitales d desempeñan un papel crucial en el estudio de la química y la física. Estos orbitales son importantes porque ayudan a determinar la configuración electrónica de los átomos y, por lo tanto, su comportamiento químico.
En la tabla periódica, los elementos se organizan en columnas llamadas grupos y en filas llamadas periodos. Cada elemento en un periodo tiene una configuración electrónica única que determina sus propiedades químicas. Los orbitales d juegan un papel importante en la configuración electrónica de los elementos en los periodos 4 a 7.
La principal característica de los orbitales d es su forma. Cada orbital d tiene una forma diferente, que se puede describir utilizando una notación específica. Esta notación utiliza números y letras para indicar la energía y la forma del orbital d. Por ejemplo, los cinco orbitales d se representan como dxy, dxz, dyz, dz2 y dx2-y2. Cada uno de estos orbitales tiene una forma distinta en el espacio y se clasifican según la orientación de sus ejes principales.
Es importante entender los orbitales d porque nos permiten predecir cómo se distribuyen los electrones alrededor del núcleo de un átomo. Esto nos ayuda a comprender las propiedades químicas de los elementos y cómo interactúan entre sí para formar compuestos.
Además, los orbitales d también están involucrados en fenómenos físicos como la absorción y emisión de luz. Cuando un electrón en un orbital d absorbe fotones de ciertas longitudes de onda, puede saltar a un orbital de mayor energía. Luego, cuando el electrón regresa a su estado original, emite fotones en las mismas longitudes de onda, lo que da lugar a la emisión de luz de diferentes colores.
Los orbitales d son cruciales para comprender cómo se organizan los electrones en los átomos y cómo interactúan para formar compuestos. También desempeñan un papel fundamental en fenómenos físicos como la absorción y emisión de luz. Por lo tanto, comprender los orbitales d es fundamental para cualquier estudio en química y física.
Preguntas frecuentes (FAQ)
1. ¿Cuántos orbitales tiene el subnivel d?
El subnivel d tiene un total de 5 orbitales.
2. ¿Cuál es la capacidad máxima de electrones en el subnivel d?
La capacidad máxima de electrones en el subnivel d es de 10.
3. ¿En qué grupos de la tabla periódica encontramos elementos con electrones en el subnivel d?
Los elementos con electrones en el subnivel d se encuentran en los grupos 3 al 12 de la tabla periódica, también conocidos como metales de transición.
4. ¿Cómo se distribuyen los electrones en los orbitales del subnivel d?
Los electrones se distribuyen de manera equitativa en los 5 orbitales del subnivel d, llenando primero un electrón en cada uno antes de emparejarlos.
5. ¿Qué importancia tienen los electrones en el subnivel d para las propiedades químicas de los elementos?
Los electrones en el subnivel d juegan un papel crucial en las propiedades químicas de los elementos, ya que su presencia puede determinar la reactividad, la capacidad para formar enlaces y otras características específicas de diferentes compuestos y aleaciones.

Entradas relacionadas