Masa Atómica Relativa: Descubre la Clave para Entender la Composición de los Elementos Químicos
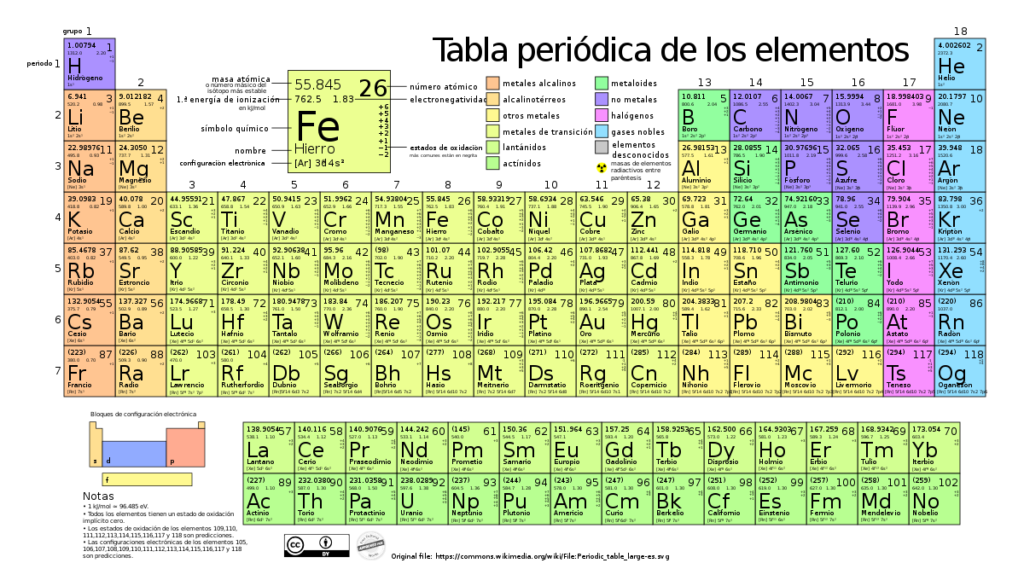
La masa atómica relativa es un concepto fundamental en la ciencia de la química. Nos permite entender y determinar la composición de los elementos químicos y cómo se combinan para formar compuestos. Además, nos brinda información sobre la cantidad de átomos presentes en una muestra de una sustancia, así como sobre su masa en relación con una unidad de medida específica.
Exploraremos en detalle qué es la masa atómica relativa y cómo se calcula. Veremos también cómo interactúa con otros conceptos clave de la química, como el número de Avogadro y las fórmulas químicas. Asimismo, analizaremos por qué es importante conocer la masa atómica relativa y cómo se utiliza en la vida cotidiana y en la investigación científica.
- Qué es la masa atómica relativa y por qué es importante en la química
- Cómo se calcula la masa atómica relativa de un elemento químico
- Cuál es la diferencia entre masa atómica y masa atómica relativa
- Cómo influyen los isótopos en la masa atómica relativa de un elemento
- Cuál es la importancia de conocer la masa atómica relativa al estudiar la composición de los compuestos químicos
- Cuáles son los usos prácticos de la masa atómica relativa en la industria química
- Cómo ha evolucionado el concepto de masa atómica relativa a lo largo de la historia
- Cuál es la relación entre la masa atómica relativa y la tabla periódica de los elementos
- Existen excepciones o fluctuaciones en la masa atómica relativa de algunos elementos
- Cómo se representa la masa atómica relativa en las ecuaciones químicas
- Cómo podemos determinar experimentalmente la masa atómica relativa de un elemento
- Cómo afecta la masa atómica relativa a las propiedades químicas de un elemento
- Preguntas frecuentes (FAQ)
Qué es la masa atómica relativa y por qué es importante en la química
La masa atómica relativa es un concepto fundamental en el campo de la química. Se utiliza para determinar la composición de los elementos químicos y entender cómo se combinan entre sí para formar compuestos. La masa atómica relativa, también conocida como peso atómico relativo, representa la comparación de la masa de un átomo con respecto a una unidad de masa estándar.
Para comprender mejor la importancia de la masa atómica relativa, es necesario primero entender qué es la masa atómica. La masa atómica es la masa total de un átomo, que se compone de protones, neutrones y electrones. Aunque los protones y neutrones contribuyen significativamente a la masa de un átomo, los electrones tienen una masa insignificante en comparación. Por lo tanto, en cálculos químicos, se considera que la masa de un átomo está principalmente determinada por su núcleo.
La masa atómica relativa es expresada en una escala relativa, tomando como referencia al isótopo más abundante del elemento. Los isótopos son átomos de un mismo elemento que tienen diferente número de neutrones. Esto significa que la masa atómica relativa no es un valor exacto, sino que puede variar dependiendo de la proporción de isotopos presentes en la naturaleza.
El uso de la masa atómica relativa es esencial en la química, ya que nos permite realizar cálculos precisos en diversas áreas de estudio. Por ejemplo, en la estequiometría, que es el estudio de las proporciones de reactivos y productos en una reacción química, la masa atómica relativa es utilizada para determinar las cantidades exactas de sustancias que reaccionan entre sí.
Además, la masa atómica relativa también nos brinda información sobre la estabilidad de los elementos y su capacidad para formar enlaces químicos. Los elementos con mayor masa atómica relativa tienden a ser más estables y menos reactivos, mientras que aquellos con menor masa atómica relativa son más propensos a formar enlaces y participar en reacciones químicas.
La masa atómica relativa es un concepto clave en la química que nos permite entender la composición de los elementos y cómo interactúan entre sí. Su uso en cálculos químicos es fundamental para lograr resultados precisos y comprender el comportamiento de las sustancias en distintas situaciones.
Cómo se calcula la masa atómica relativa de un elemento químico
La masa atómica relativa es una propiedad fundamental de los elementos químicos. Permite entender la composición y estructura de los átomos, así como también su relación con otros elementos en la tabla periódica. Calcular la masa atómica relativa de un elemento es un proceso que requiere de varios factores y fórmulas específicas.
La masa atómica relativa se obtiene mediante la comparación de la masa de un átomo de un elemento en particular con la masa de un átomo de referencia. El átomo de referencia es el carbono-12 (^12C), el cual se ha establecido como el estándar para medir las masas atómicas relativas de todos los elementos.
Método basado en el isótopo y abundancia
En la naturaleza, la mayoría de los elementos existen en forma de diferentes isótopos, que son átomos del mismo elemento con diferente número de neutrones en su núcleo. Cada isótopo tiene una masa relativa diferente y una abundancia relativa en la naturaleza. Para calcular la masa atómica relativa de un elemento, se debe considerar tanto la masa de cada isótopo como su proporción en la muestra analizada.
El cálculo de la masa atómica relativa utilizando este método implica multiplicar la masa de cada isótopo por su abundancia relativa, sumar los productos y dividir el resultado entre 100. Esto se expresa matemáticamente de la siguiente manera:
Masa atómica relativa = (Masa isótopo_1 * Abundancia isótopo_1) + (Masa isótopo_2 * Abundancia isótopo_2) + ... / 100
Por ejemplo, si queremos calcular la masa atómica relativa del cloro, que tiene dos isótopos principales (cloro-35 y cloro-37) con una abundancia relativa de 75.77% y 24.23%, respectivamente, el cálculo sería:
Masa atómica relativa_Cl = (Masa_Cl-35 * 75.77) + (Masa_Cl-37 * 24.23) / 100
Ejemplo de cálculo de masa atómica relativa del cloro
Para el cloro, el isótopo cloro-35 tiene una masa de 34.9688527 u (unidades de masa atómica), mientras que el isótopo cloro-37 tiene una masa de 36.9659026 u. Sustituyendo estos valores en la fórmula anterior, obtendríamos:
Masa atómica relativa_Cl = (34.9688527 * 75.77) + (36.9659026 * 24.23) / 100
Realizando los cálculos correspondientes, se obtiene una masa atómica relativa del cloro de aproximadamente 35.453 u. Esto significa que, en promedio, un átomo de cloro pesa alrededor de 35.453 veces más que un átomo de carbono-12.
Es importante destacar que la masa atómica relativa no es un número entero porque se basa en una ponderación de los isótopos de cada elemento y sus respectivas abundancias. Por lo tanto, la masa atómica relativa suele ser un valor decimal.
Calcular la masa atómica relativa de un elemento químico implica considerar las masas y abundancias relativas de sus isótopos principales. Utilizando fórmulas específicas, es posible obtener un valor que representa la relación promedio de masa del átomo de ese elemento con respecto al carbono-12. Esta información es esencial para entender la composición y comportamiento de los elementos en la química.
Cuál es la diferencia entre masa atómica y masa atómica relativa
Para comprender la diferencia entre masa atómica y masa atómica relativa, es necesario primero entender qué significa cada término en el contexto de la química. La masa atómica se refiere a la masa de un átomo en particular, mientras que la masa atómica relativa es una medida de la masa promedio de los átomos de un elemento determinado en comparación con la unidad de masa atómica.
La masa atómica se expresa en unidades de masa atómica (u), donde 1 u es igual a la doceava parte de la masa del isótopo carbono-12. Aunque la masa atómica de cada isótopo individual varía, se utiliza una masa promedio ponderada para calcular la masa atómica relativa de un elemento.
La masa atómica relativa se calcula considerando las abundancias relativas de los diferentes isótopos de un elemento y sus correspondientes masas atómicas. La fórmula para calcularla es la siguiente:
MAR = (M₁ x A₁ + M₂ x A₂ + ... + Mₙ x Aₙ) / 100
Donde MAR es la masa atómica relativa, M es la masa atómica de cada isótopo y A es su respectiva abundancia relativa.
Es importante destacar que la masa atómica relativa es una propiedad característica de cada elemento y se utiliza para identificarlos y clasificarlos en la tabla periódica. Además, también permite realizar cálculos relacionados con las reacciones químicas, como el cálculo de la masa molar de un compuesto.
La masa atómica se refiere a la masa de un átomo individual, mientras que la masa atómica relativa es una medida promedio de la masa de los átomos de un elemento considerando sus isótopos y sus respectivas abundancias. Ambas son herramientas clave en el estudio de la química y nos ayudan a comprender la composición de los elementos y las propiedades de las sustancias que forman.
Cómo influyen los isótopos en la masa atómica relativa de un elemento
La masa atómica relativa es una propiedad fundamental de los elementos químicos que nos permite comprender la composición de la materia. Pero, ¿alguna vez te has preguntado cómo influyen los isótopos en esta magnitud? Los isótopos son variantes de un mismo elemento, que tienen la misma cantidad de protones en su núcleo pero difieren en la cantidad de neutrones.
Para entender cómo los isótopos afectan la masa atómica relativa, debemos tener en cuenta que la masa de un átomo está determinada por la suma de las masas de sus protones, neutrones y electrones. Los protones y neutrones tienen aproximadamente la misma masa, mientras que los electrones tienen una masa despreciable en comparación. Por lo tanto, podemos decir que la masa de un átomo está casi completamente determinada por su núcleo, donde se encuentran los protones y neutrones.
Al haber diferentes isótopos de un mismo elemento, cada isótopo tiene una masa ligeramente diferente debido a la diferencia en el número de neutrones. Esto significa que la masa atómica relativa de un elemento es un promedio ponderado de las masas de sus isótopos, considerando la abundancia natural de cada uno.
La masa atómica relativa se expresa en unidades de masa atómica (u) y se calcula mediante la fórmula:
Masa Atómica Relativa = (masa del primer isótopo * abundancia del primer isótopo) + (masa del segundo isótopo * abundancia del segundo isótopo) + ...
Donde la masa de un isótopo se refiere a la masa de ese isótopo específico en unidades de masa atómica y la abundancia se refiere a la proporción de ese isótopo presente en la naturaleza.
Es importante destacar que la masa atómica relativa no es un número entero, ya que es una media ponderada de las masas de los diferentes isótopos. Por ejemplo, si consideramos el elemento carbono, sabemos que tiene tres isótopos principales: carbono-12, carbono-13 y carbono-14. La masa atómica relativa del carbono es aproximadamente 12.01 u, lo que indica que, en promedio, un átomo de carbono pesa aproximadamente 12 veces más que un átomo de hidrógeno.
Importancia de la masa atómica relativa en la química
La masa atómica relativa es una propiedad crucial en la química, ya que nos permite realizar cálculos estequiométricos precisos y comprender la relación entre las cantidades de sustancias en una reacción química. A través de la ley de las proporciones definidas, podemos determinar las relaciones molares entre elementos y compuestos, utilizando la masa atómica relativa como guía.
Además, la masa atómica relativa también es utilizada para determinar la composición isotópica de un elemento en una muestra, permitiéndonos identificar la presencia de isótopos raros o radiactivos. En campos como la geología, arqueología y física nuclear, el análisis de la masa atómica relativa de los elementos es esencial para obtener información sobre procesos naturales y artificiales.
La masa atómica relativa es una propiedad clave en la química que nos permite entender la composición de los elementos químicos. Es determinada por la suma ponderada de las masas de los isótopos presentes en la naturaleza y se utiliza para realizar cálculos estequiométricos precisos y analizar la composición isotópica de las muestras. ¡No subestimes el poder de la masa atómica relativa en el mundo de la química!
Cuál es la importancia de conocer la masa atómica relativa al estudiar la composición de los compuestos químicos
La masa atómica relativa es un concepto fundamental en la química y juega un papel esencial en la comprensión de la composición de los elementos químicos. Conocer la masa atómica relativa de un elemento nos proporciona información crucial sobre la cantidad de átomos presentes en una muestra determinada.
La masa atómica relativa se define como la masa promedio ponderada de los isótopos de un elemento en comparación con la unidad de masa atómica, que se define como 1/12 de la masa del átomo de carbono-12. Esta unidad arbitraria permite estandarizar la comparación de las masas de diferentes átomos.
¿Cómo se calcula la masa atómica relativa?
El cálculo de la masa atómica relativa se basa en la abundancia isotópica de cada isótopo del elemento y su masa atómica correspondiente. La abundancia isotópica es la proporción relativa de cada isótopo en una muestra de dicho elemento.
Para calcular la masa atómica relativa, se multiplican las abundancias isotópicas de cada isótopo por su respectiva masa atómica y se suman estos productos para todos los isótopos presentes en el elemento. El resultado es la masa atómica relativa del elemento.
Es importante destacar que debido a la existencia de isótopos con diferente número de neutrones, la masa atómica relativa no siempre es un número entero. En muchos casos, la masa atómica relativa se presenta como un valor decimal.
Aplicaciones de la masa atómica relativa en la química
La masa atómica relativa es una herramienta fundamental en diversos campos de la química. Una de sus aplicaciones más importantes es en la determinación de la fórmula química de los compuestos.
Al conocer la masa atómica relativa de los elementos que componen un compuesto, es posible determinar la proporción en la que se combinan estos elementos para formar dicha sustancia. Esto permite determinar la fórmula química y la estructura del compuesto.
Además, la masa atómica relativa también es utilizada en la estequiometría, que es el estudio de las relaciones cuantitativas entre los reactivos y los productos en una reacción química. La masa atómica relativa nos proporciona información sobre la cantidad de substancias involucradas y sobre las masas relativas de los reactivos y los productos.
La masa atómica relativa es un concepto fundamental en la química y es clave para entender la composición de los elementos químicos. Su cálculo nos permite determinar la proporción en la que los átomos se combinan para formar compuestos y nos proporciona información valiosa sobre las masas relativas en las reacciones químicas. Es una herramienta esencial para los químicos y su conocimiento es fundamental para el estudio y comprensión de la materia.
Cuáles son los usos prácticos de la masa atómica relativa en la industria química
La masa atómica relativa es una propiedad fundamental de los elementos químicos que desempeña un papel crucial en la industria química. Esta magnitud, también conocida como peso atómico relativo, se define como la relación entre la masa de un átomo de un elemento y 1/12 de la masa del átomo de carbono-12.
Los usos prácticos de la masa atómica relativa en la industria química son muy variados y tienen un impacto significativo en la producción de diversos productos y materiales utilizados en nuestra vida cotidiana.
Análisis y caracterización de sustancias
Uno de los usos más comunes de la masa atómica relativa es en el análisis y caracterización de sustancias. Al conocer la masa atómica relativa de los elementos presentes en una muestra, los químicos pueden determinar la composición elemental y calcular la proporción de cada componente. Esto es especialmente importante en análisis cualitativos y cuantitativos, donde es necesario identificar y medir las cantidades de los diferentes elementos presentes en una muestra.
Además, la masa atómica relativa permite la identificación de isotopos. Los isotopos son átomos de un mismo elemento con diferentes masas atómicas debido al número de neutrones en su núcleo. Estos pueden tener propiedades químicas similares pero características físicas distintas. La capacidad para identificar y medir la proporción de isotopos es esencial en muchas aplicaciones industriales, como la datación por radiocarbono o la identificación de contaminantes en productos químicos.
Producción y diseño de nuevos materiales
Otro uso importante de la masa atómica relativa en la industria química es en la producción y diseño de nuevos materiales. La masa atómica relativa proporciona información valiosa sobre las propiedades físicas y químicas de los elementos, lo cual es fundamental para seleccionar los materiales adecuados para diferentes aplicaciones.
Los ingenieros y científicos pueden utilizar la masa atómica relativa para calcular la densidad, resistencia y conductividad de un material, entre otras propiedades. Esto les permite diseñar materiales con características específicas que cumplen con los requisitos técnicos y funcionales de una determinada aplicación. Por ejemplo, en la industria aeroespacial se requieren materiales ligeros pero resistentes, y la masa atómica relativa puede ayudar a identificar los elementos ideales para lograr estas propiedades.
Síntesis y optimización de reacciones químicas
La masa atómica relativa también desempeña un papel clave en la síntesis y optimización de reacciones químicas. Al conocer la masa atómica relativa de los reactantes y productos involucrados en una reacción, los químicos pueden calcular las proporciones estequiométricas necesarias para obtener el rendimiento óptimo del proceso.
Además, la masa atómica relativa permite el cálculo de masas molares y la determinación de moles en una sustancia. Estos datos son esenciales para realizar conversiones entre unidades de masa y volumen, lo cual es fundamental para la preparación de soluciones químicas y la dosificación precisa de sustancias en diferentes procesos industriales.
La masa atómica relativa desempeña un papel fundamental en la industria química al permitir el análisis y caracterización de sustancias, la producción y diseño de nuevos materiales, y la síntesis y optimización de reacciones químicas. Su conocimiento es vital para los profesionales de la química y contribuye significativamente al desarrollo y avance de esta ciencia fundamental.
Cómo ha evolucionado el concepto de masa atómica relativa a lo largo de la historia
El concepto de masa atómica relativa ha experimentado una evolución significativa a lo largo de la historia de la química. En sus inicios, los científicos reconocieron que los elementos químicos estaban compuestos por átomos, pero no tenían una forma precisa de medir o comparar las masas de estos átomos entre sí.
Fue Antoine Lavoisier en el siglo XVIII quien introdujo el concepto de masa atómica relativa. Lavoisier realizó experimentos en los que analizó la composición y reacciones químicas de diferentes sustancias, estableciendo una correlación entre las masas de los elementos presentes en una reacción química. A partir de estos estudios, Lavoisier propuso un sistema de medidas relativas para expresar las masas de los elementos en relación con un estándar, siendo el hidrógeno el elemento de referencia.
La importancia del desarrollo de la tabla periódica
El concepto de masa atómica relativa tomó mayor relevancia con el desarrollo de la tabla periódica de los elementos químicos. Dmitri Mendeléyev, junto con otros científicos de la época, trabajaron en la clasificación de los elementos según sus propiedades químicas y físicas observadas experimentalmente.
Mendeléyev concibió una tabla periódica en la que los elementos se organizaron de acuerdo a su masa atómica, permitiendo así identificar patrones y regularidades en las propiedades de los elementos. La masa atómica relativa fue una herramienta fundamental en este proceso, ya que permitía ordenar correctamente los elementos en función de su masa y establecer las relaciones entre ellos.
El desarrollo de técnicas de medición más precisas
A medida que la tecnología avanzaba, los científicos fueron capaces de desarrollar técnicas de medición más precisas para determinar las masas atómicas relativas. Una de las técnicas utilizadas es la espectrometría de masas, que permite identificar los distintos isótopos presentes en un elemento y determinar su abundancia relativa.
Otra técnica importante es la cromatografía de gases, que permite separar y analizar los diferentes componentes de una muestra. Estas técnicas modernas han contribuido en gran medida a la comprensión y refinamiento del concepto de masa atómica relativa.
Aplicaciones de la masa atómica relativa
La masa atómica relativa es crucial en el campo de la química, ya que proporciona información sobre la composición de los elementos y permite calcular las proporciones en las que se combinan en reacciones químicas. Esta información es fundamental para el diseño de experimentos y la comprensión de los procesos químicos.
Además, la masa atómica relativa también es utilizada en la industria y la investigación, especialmente en campos como la síntesis orgánica, la farmacología y la nanotecnología. La masa atómica relativa nos ayuda a comprender cómo se comportan los átomos en las reacciones químicas y a diseñar materiales y compuestos con propiedades específicas.
Cuál es la relación entre la masa atómica relativa y la tabla periódica de los elementos
La masa atómica relativa es un concepto fundamental en la química que nos permite comprender y analizar la composición de los elementos presentes en la tabla periódica. Es una medida que indica cuántas veces es más pesado un átomo en comparación con el átomo estándar de carbono-12. A través de este valor, podemos entender las relaciones entre los diferentes elementos y su posición en la tabla periódica.
En la tabla periódica, los elementos están ordenados de manera sistemática según su número atómico, que representa la cantidad de protones en el núcleo del átomo. La masa atómica relativa se expresa en unidades de masa atómica (uma o dalton) y es la masa promedio ponderada de los isótopos naturales de un elemento teniendo en cuenta su abundancia relativa.
Cómo se calcula la masa atómica relativa
Para calcular la masa atómica relativa de un elemento, se requiere conocer tanto la masa de cada uno de sus isótopos como su abundancia natural en la Tierra. La masa de un isótopo es la suma de la cantidad de protones y neutrones en el núcleo del átomo. Por otro lado, la abundancia natural es la frecuencia relativa de ese isótopo en relación con todos los isótopos del mismo elemento.
Una vez que se conocen estos valores, se realiza un cálculo matemático para obtener la masa atómica relativa. Se multiplica la masa de cada isótopo por su abundancia natural, y se suman estos productos para todos los isótopos del elemento. Este resultado es la masa atómica relativa.
Importancia de la masa atómica relativa
La masa atómica relativa es una herramienta esencial para entender la química y las propiedades de los elementos. Nos permite calcular las proporciones en las que se combinan los átomos y compuestos en una reacción química, lo que es fundamental para entender la estequiometría.
También nos ayuda a entender las propiedades físicas y químicas de los elementos y cómo se relacionan entre sí. Por ejemplo, en la tabla periódica podemos observar cómo los elementos con masa atómica más baja suelen ser los más abundantes en la naturaleza, mientras que aquellos con masa atómica más alta pueden tener propiedades más particulares o raros.
Además, la masa atómica relativa también está relacionada con el concepto de mol. El mol es una unidad de cantidad de sustancia y se basa en la masa atómica relativa para realizar cálculos en química. La relación entre la masa atómica relativa y el concepto de mol es fundamental para comprender y aplicar la ley de Avogadro y realizar conversiones entre masa y número de partículas.
- Permite entender la composición de los elementos en la tabla periódica.
- Fundamental para la estequiometría y cálculos químicos.
- Relacionado con las propiedades físicas y químicas de los elementos.
- Base para el concepto de mol y cálculos estequiométricos.
La masa atómica relativa es clave para entender la composición de los elementos químicos y su relación dentro de la tabla periódica. Nos proporciona información sobre la composición isotópica de un elemento y permite realizar cálculos químicos y estequiometría. Es una herramienta esencial para los químicos y científicos en el estudio y comprensión de las propiedades de los elementos y su comportamiento en reacciones químicas.
Existen excepciones o fluctuaciones en la masa atómica relativa de algunos elementos
La masa atómica relativa es una medida clave para entender la composición de los elementos químicos en un nivel más profundo. Sin embargo, es importante tener en cuenta que existen excepciones y fluctuaciones en la masa atómica relativa de algunos elementos.
Estas excepciones pueden deberse a diversos factores, como la presencia de isótopos naturales de un determinado elemento. Los isótopos son átomos que tienen el mismo número de protones en su núcleo, pero difieren en el número de neutrones. Esto significa que pueden variar en sus masas atómicas, lo que a su vez afecta la masa atómica relativa del elemento en cuestión.
Un ejemplo común de una excepción en la masa atómica relativa es el cloro. El cloro tiene dos isótopos estables: el cloro-35 y el cloro-37. El cloro-35 es mucho más abundante en la naturaleza que el cloro-37, por lo que la masa atómica relativa del cloro se calcula utilizando un promedio ponderado de las masas de estos dos isótopos. Esto da como resultado una masa atómica relativa para el cloro de aproximadamente 35,5 unidades de masa atómica (uma).
Otro ejemplo notable es el hidrógeno. Aunque el hidrógeno-1 es el isótopo más común y ligero del hidrógeno, existe otro isótopo llamado deuterio, o hidrógeno-2. El deuterio tiene un neutrón adicional en su núcleo, lo que le confiere una masa atómica relativa de aproximadamente 2 uma. Estas fluctuaciones en la masa atómica relativa del hidrógeno son importantes en varios campos científicos, como la química orgánica y la espectroscopia.
Es importante tener en cuenta estas excepciones y fluctuaciones en la masa atómica relativa al realizar cálculos y análisis químicos precisos. Siempre se debe consultar una tabla periódica actualizada para obtener los valores más precisos de la masa atómica relativa de cada elemento.
La masa atómica relativa es una herramienta fundamental para comprender la composición de los elementos químicos. Sin embargo, existen excepciones y fluctuaciones en la masa atómica relativa debido a la presencia de isótopos naturales. Estas variaciones deben tenerse en cuenta al realizar cálculos y análisis químicos para garantizar resultados precisos. Mantenerse actualizado con una tabla periódica confiable es esencial para utilizar los valores más precisos de la masa atómica relativa de cada elemento.
Cómo se representa la masa atómica relativa en las ecuaciones químicas
La masa atómica relativa es un concepto fundamental en la química. Es la clave para entender la composición de los elementos y su participación en las reacciones químicas. En este artículo, vamos a descubrir cómo se representa la masa atómica relativa en las ecuaciones químicas.
En primer lugar, es importante comprender qué es exactamente la masa atómica relativa. La masa atómica relativa es la masa promedio de los isótopos de un elemento, teniendo en cuenta su abundancia relativa en la naturaleza. Los isótopos son átomos del mismo elemento que tienen el mismo número atómico pero difieren en el número de neutrones en su núcleo.
Representación de la masa atómica relativa
En las ecuaciones químicas, la masa atómica relativa de un elemento se representa mediante su símbolo químico y un número subíndice. Este número subíndice es igual a la masa atómica relativa del elemento.
Por ejemplo, el carbono tiene una masa atómica relativa de aproximadamente 12.01 u (unidades de masa atómica), por lo que su representación en una ecuación química sería C12.01.
De manera similar, el oxígeno tiene una masa atómica relativa de aproximadamente 16.00 u, por lo que su representación en una ecuación química sería O16.00.
Es importante tener en cuenta que la masa atómica relativa se utiliza para calcular las proporciones en las reacciones químicas. Por ejemplo, si queremos determinar la cantidad de oxígeno necesaria para reaccionar con una cierta cantidad de carbono, utilizaremos las masas atómicas relativas de ambos elementos para calcular las proporciones exactas.
Utilizando la masa atómica relativa en los cálculos estequiométricos
Los cálculos estequiométricos son una parte integral de la química. Estos cálculos nos permiten determinar las cantidades exactas de sustancias necesarias para una reacción química dada.
La masa atómica relativa es esencial en los cálculos estequiométricos, ya que nos proporciona la base para determinar las relaciones de masa entre los elementos y compuestos involucrados en la reacción.
Por ejemplo, supongamos que queremos determinar cuántos gramos de dióxido de carbono se formarán al quemar 25 gramos de metano (CH4). Primero, debemos equilibrar la ecuación química y luego utilizar las masas atómicas relativas para realizar los cálculos estequiométricos.
CH4 + 2O2 → CO2 + 2H2O
De la ecuación química, podemos ver que se requieren 1 mol de metano para producir 1 mol de dióxido de carbono. Luego, utilizando las masas atómicas relativas del carbono y el oxígeno, podemos determinar la masa exacta de dióxido de carbono producida.
La masa atómica relativa es una representación clave de los elementos en las ecuaciones químicas. Nos permite determinar las proporciones precisas de los elementos y compuestos involucrados en las reacciones químicas, y es esencial para realizar cálculos estequiométricos precisos. Comprender cómo se representa y utiliza la masa atómica relativa nos brinda una herramienta fundamental para comprender y analizar la composición de los elementos químicos.
Cómo podemos determinar experimentalmente la masa atómica relativa de un elemento
La masa atómica relativa es una medida importante en la química, ya que nos permite comprender la composición de los elementos y su papel en las reacciones químicas. Pero, ¿cómo podemos determinar experimentalmente la masa atómica relativa de un elemento?
En primer lugar, es importante recordar que la masa atómica relativa se refiere a la masa promedio de los átomos de un elemento en relación con la unidad de masa atómica, que se define como la doceava parte de la masa de un átomo de carbono-12. Por lo tanto, para determinar la masa atómica relativa de un elemento, debemos medir cuidadosamente las masas de los átomos individuales y luego promediarlos.
Espectrometría de masas: una herramienta fundamental
Una de las técnicas más utilizadas para determinar la masa atómica relativa es la espectrometría de masas. Esta técnica se basa en el principio de que los iones cargados pueden ser separados y analizados en función de su relación carga-masa.
En un espectrómetro de masas, las muestras se ionizan, es decir, se les remueven electrones para producir iones cargados positivamente o negativamente. Estos iones son acelerados a través de un campo eléctrico y luego se someten a un campo magnético, que causa la desviación de los iones en función de su relación carga-masa.
Al introducir el isótopo de interés en el espectrómetro de masas, podemos observar diferentes picos en el espectro de masas que corresponden a diferentes iones con diferentes masas. Al medir la relación de intensidad entre los picos y aplicar cálculos matemáticos, podemos determinar la masa atómica relativa del isótopo.
Espectroscopía de absorción y emisión: una aproximación complementaria
Otra técnica comúnmente utilizada para determinar la masa atómica relativa es la espectroscopía de absorción y emisión. Esta técnica se basa en el hecho de que los átomos en un estado excitado pueden emitir radiación electromagnética característica cuando vuelven a su estado fundamental.
En la espectroscopía de absorción, los átomos absorben luz de una longitud de onda específica y se excitan a estados energéticos superiores. Luego, al volver a su estado fundamental, emiten radiación electromagnética en longitudes de onda características. Al analizar el espectro de absorción y emisión de los átomos, se puede determinar la masa atómica relativa a través de fórmulas y relaciones matemáticas.
Otras técnicas disponibles
Aparte de la espectrometría de masas y la espectroscopía de absorción y emisión, existen otras técnicas disponibles para determinar la masa atómica relativa. Algunas de estas técnicas incluyen la difracción de rayos X, la resonancia magnética nuclear (RMN) y la cromatografía de gases.
En la difracción de rayos X, los átomos de una muestra se someten a un haz de rayos X y se produce una dispersión de los rayos a través de los átomos. Al analizar el patrón de difracción resultante, se pueden deducir las posiciones relativas de los átomos y, por lo tanto, su masa atómica relativa.
En la resonancia magnética nuclear (RMN), los núcleos atómicos se alinean en campo magnético y se emiten señales de radiofrecuencia que están relacionadas con las propiedades magnéticas de los núcleos. Estas señales se pueden analizar y, mediante cálculos matemáticos, se puede obtener información sobre las masas atómicas relativas de los elementos presentes en la muestra.
Por último, la cromatografía de gases se utiliza comúnmente para separar y analizar mezclas complejas. En esta técnica, una muestra se inyecta en un sistema de columna y se separa en sus componentes individuales. Luego, mediante la detección y cuantificación de cada componente, se puede determinar su masa atómica relativa.
Hay varias técnicas disponibles para determinar experimentalmente la masa atómica relativa de un elemento. La espectrometría de masas, la espectroscopía de absorción y emisión, la difracción de rayos X, la RMN y la cromatografía de gases son algunas de las herramientas más utilizadas en este campo. Cada técnica tiene sus propias ventajas y desventajas, y la elección de la técnica adecuada depende de la naturaleza de la muestra y del objetivo del estudio. Con estas técnicas a nuestra disposición, podemos desbloquear la clave para comprender la composición de los elementos químicos.
Cómo afecta la masa atómica relativa a las propiedades químicas de un elemento
La masa atómica relativa es un concepto fundamental en la química que nos permite entender la composición de los elementos y cómo se relacionan entre sí. Aunque puede parecer complicado al principio, comprender la masa atómica relativa es clave para desvelar las propiedades químicas de los elementos.
La masa atómica relativa, también conocida como peso atómico relativo, es una medida relativa de la masa de un átomo en comparación con otros átomos. Se expresa en unidades de masa atómica, siendo la unidad de referencia el carbono-12, que tiene una masa atómica relativa de exactamente 12 unidades.
La masa atómica relativa de un elemento se calcula considerando la abundancia de sus diferentes isótopos y la masa de cada uno. Los isótopos son átomos del mismo elemento que tienen un número diferente de neutrones en su núcleo. Debido a estas variaciones en la masa, el cálculo de la masa atómica relativa implica un promedio ponderado de las diferentes masas isotópicas.
¿Pero por qué es importante conocer la masa atómica relativa? Bueno, resulta que esta propiedad está estrechamente relacionada con muchas otras características de los elementos químicos.
1. La masa atómica relativa y las propiedades físicas
La masa atómica relativa influye en las propiedades físicas de los elementos. Por ejemplo, en general, la densidad de un elemento aumenta a medida que su masa atómica relativa se incrementa. Esto se debe a que la masa de un átomo está relacionada con su tamaño y la densidad es la relación entre masa y volumen.
Además, la masa atómica relativa también puede influir en el punto de fusión y ebullición de los elementos. En general, aquellos con una masa atómica relativa más alta tendrán puntos de fusión y ebullición más altos, ya que los átomos con masas mayores requerirán más energía para separarse y convertirse en líquidos o gases.
2. La masa atómica relativa y las propiedades químicas
La masa atómica relativa también juega un papel importante en las propiedades químicas de los elementos. Por ejemplo, determina la capacidad de un átomo para formar enlaces químicos.
En general, los elementos con una masa atómica relativa baja tienden a ser más reactivos, ya que sus átomos tienen menor cantidad de electrones y estos se encuentran más alejados del núcleo, lo que facilita las interacciones químicas.
Por otro lado, los elementos con una masa atómica relativa alta tienden a ser menos reactivos, ya que sus átomos tienen una mayor cantidad de electrones y estos se encuentran más cerca del núcleo, lo que dificulta las interacciones químicas.
3. La masa atómica relativa y el cálculo de moles
La masa atómica relativa también está vinculada al concepto de mol, que es una unidad utilizada en química para contar átomos, moléculas o partículas.
Para convertir una determinada cantidad de sustancia en moles, es necesario conocer la masa atómica relativa del elemento o compuesto. A partir de esta información, se puede realizar el cálculo utilizando la fórmula matemática adecuada.
Moles = Masa (g) / Masa atómica relativa (g/mol)
Mediante este cálculo, podemos determinar cuántos moles hay en una muestra de una sustancia y utilizar esta información para realizar diversos cálculos estequiométricos.
La masa atómica relativa desempeña un papel fundamental en la química al proporcionarnos información crucial sobre la composición y las propiedades de los elementos químicos. A través de su conocimiento, podemos comprender mejor la relación entre la estructura atómica y las características físicas y químicas de la materia.
Así que, la próxima vez que te encuentres estudiando un elemento o realizando experimentos químicos, recuerda considerar la masa atómica relativa. Te ayudará a desvelar los secretos de los elementos y ampliará tu comprensión de la química en general.
Preguntas frecuentes (FAQ)
1. ¿Qué es la masa atómica relativa?
La masa atómica relativa es la medida de la masa de un átomo en comparación con la unidad de masa atómica definida como 1/12 de la masa del átomo carbono-12.
2. ¿Cómo se calcula la masa atómica relativa?
La masa atómica relativa se calcula considerando el peso isotópico y la abundancia de los diferentes isotopos de un elemento químico.
3. ¿Cuál es la utilidad de conocer la masa atómica relativa?
Conocer la masa atómica relativa es útil para determinar la cantidad relativa de átomos en una muestra y para calcular la masa molar de compuestos químicos.
4. ¿Por qué la masa atómica relativa no es un número entero?
La masa atómica relativa no es un número entero porque se promedia la masa de los diferentes isótopos de un elemento, teniendo en cuenta su abundancia relativa en la naturaleza.
5. ¿Dónde se encuentran disponibles los valores de la masa atómica relativa?
Los valores de la masa atómica relativa se pueden encontrar en la tabla periódica de los elementos químicos.

Entradas relacionadas