Principio de Exclusión de Pauli: ¿Cómo funciona y por qué es crucial para entender la materia?
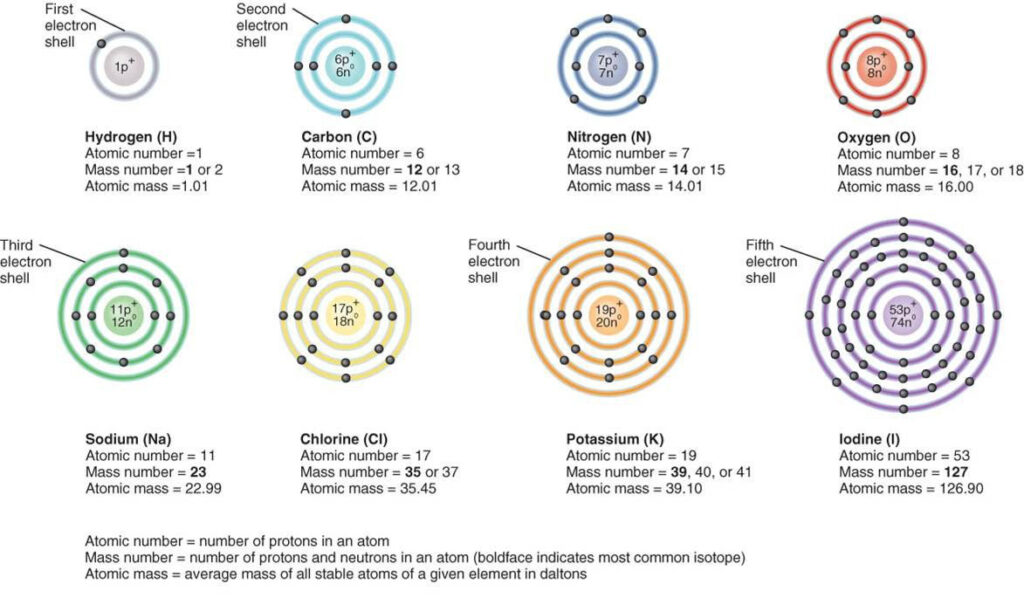
El principio de exclusión de Pauli, formulado por el físico austriaco Wolfgang Pauli en 1925, es uno de los principios fundamentales de la física cuántica. Este principio establece que dos fermiones idénticos, como electrones o protones, no pueden ocupar el mismo estado cuántico simultáneamente. Es decir, dos partículas no pueden tener todos sus números cuánticos idénticos.
Exploraremos en detalle cómo funciona el principio de exclusión de Pauli y por qué es crucial para entender la estructura y propiedades de la materia. Veremos cómo este principio se aplica a los electrones en los átomos y cómo determina las configuraciones electrónicas y las propiedades químicas de los elementos. También discutiremos la importancia del principio de exclusión de Pauli en otros fenómenos cuánticos, como la formación de estados degenerados y las estadísticas de Fermi-Dirac.
- -Aplicación práctica: ¿Cómo se manifiesta el principio de exclusión de Pauli en la vida cotidiana?
- Conclusión
- -Historia y descubrimiento: ¿Quién fue Pauli y cómo descubrió este principio fundamental?
- -Interacción entre partículas: ¿Cuál es el impacto del principio de exclusión en la interacción y comportamiento de las partículas subatómicas?
- -Principio de llenado de orbitales: ¿Cómo funciona el principio de exclusión de Pauli en relación con la configuración electrónica de los átomos?
- -Relación con el electromagnetismo: ¿De qué manera se vincula el principio de exclusión de Pauli con las propiedades eléctricas y magnéticas de los materiales?
- -La importancia para la química y la física: ¿Por qué el principio de exclusión de Pauli es crucial para comprender fenómenos como la estructura atómica y la conductividad eléctrica?
- -Uso en ciencias modernas: ¿En qué áreas de investigación, como la teoría de la superconductividad o la física nuclear, se aplica el principio de exclusión de Pauli?
- -Retos y futuro: ¿Qué retos enfrentan los científicos al intentar comprender mejor este principio y cómo podría evolucionar nuestra comprensión en el futuro?
- -Impacto en las teorías fundamentales: ¿Cómo ha influido el principio de exclusión de Pauli en la formulación de las teorías cuánticas y en la base del conocimiento científico actual?
- Preguntas frecuentes (FAQ)
-Aplicación práctica: ¿Cómo se manifiesta el principio de exclusión de Pauli en la vida cotidiana?
s y el condensado de Bose-Einstein. En los sólidos, los electrones se distribuyen en bandas de energía, y debido al principio de exclusión de Pauli, cada nivel puede ser ocupado solo por dos electrones con espines opuestos. Esto contribuye a la estabilidad y rigidez de los materiales.
En el caso de los superfluidos, como el helio-4, las partículas forman pares conocidos como bosones de Cooper. Estos pares pueden ocupar el mismo estado cuántico, lo que da lugar a fenómenos como la fluidez sin viscosidad y la superconductividad a altas temperaturas.
Conclusión
El principio de exclusión de Pauli es una de las bases fundamentales de la física cuántica y tiene aplicaciones prácticas en campos tan diversos como la estructura electrónica de los átomos, la resistencia eléctrica de los materiales y las propiedades de la materia condensada. Comprender este principio es esencial para comprender cómo funciona la materia a nivel microscópico y abre puertas a investigaciones y desarrollos tecnológicos en áreas como la electrónica, la química y la física de materiales.
-Historia y descubrimiento: ¿Quién fue Pauli y cómo descubrió este principio fundamental?
El principio de exclusión de Pauli, nombrado en honor al físico austriaco Wolfgang Pauli, es uno de los pilares fundamentales de la física cuántica. Fue formulado por Pauli en 1925 y se refiere a cómo los electrones se organizan en los átomos y moléculas. Su descubrimiento fue el resultado de una extensa investigación sobre la estructura electrónica y las propiedades de los elementos químicos.
Wolfgang Pauli nació el 25 de abril de 1900 en Viena, Austria. Desde joven mostró un gran interés por la física y estudió en la Universidad de Múnich, donde se especializó en mecánica cuántica. Durante sus estudios, trabajó estrechamente con otros científicos destacados, como Niels Bohr y Werner Heisenberg.
Fue en 1924 cuando Pauli comenzó a desarrollar su famoso principio de exclusión. En ese momento, muchos físicos estaban tratando de comprender cómo los electrones se distribuyen en los átomos y cómo esto afecta las propiedades de los elementos químicos. A través de sus investigaciones, Pauli llegó a la conclusión de que dos electrones no pueden ocupar el mismo estado cuántico simultáneamente.
Esta idea revolucionaria fue un punto de inflexión en la comprensión de la estructura electrónica y proporcionó una base sólida para explicar muchas de las propiedades y comportamientos observados en los átomos. El principio de exclusión de Pauli establece que cada electron tiene un conjunto único de cuatro números cuánticos (n, l, m, s), que representan su estado cuántico. Estos números determinan la posición, la energía, el momento angular y el espín de un electrón en un átomo.
El principio de exclusión de Pauli también se aplica a otras partículas, como los fermiones, que incluyen protones y neutrones. Estos fermiones obedecen el mismo principio y no pueden ocupar el mismo estado cuántico simultáneamente. Esto tiene importantes implicaciones para entender la estructura de la materia y la formación de enlaces químicos.
El descubrimiento del principio de exclusión de Pauli fue un avance significativo en la comprensión de la física cuántica y sigue siendo ampliamente estudiado y aplicado en la actualidad. Su impacto se extiende más allá de la física, ya que también se ha utilizado para explicar fenómenos en diversos campos, como la química, la biología y la astrofísica. El principio de exclusión de Pauli es una piedra angular en nuestra comprensión de cómo funciona la materia a nivel microscópico y continúa generando investigaciones y avances en la actualidad.
-Interacción entre partículas: ¿Cuál es el impacto del principio de exclusión en la interacción y comportamiento de las partículas subatómicas?
El principio de exclusión de Pauli es un concepto fundamental en la física cuántica que tiene un impacto significativo en la interacción y comportamiento de las partículas subatómicas. Este principio establece que dos partículas idénticas no pueden ocupar el mismo estado cuántico al mismo tiempo.
Para comprender el principio de exclusión de Pauli, es necesario tener en cuenta que las partículas subatómicas, como electrones, protones y neutrones, se rigen por las leyes de la mecánica cuántica. A diferencia de las partículas clásicas, las partículas cuánticas no están definidas por variables deterministas, sino que se describen mediante funciones de onda que representan su probabilidad de existencia en diferentes estados.
El principio de exclusión de Pauli se aplica específicamente a los fermiones, una clase de partículas subatómicas que incluye electrones, protones y neutrones. Los fermiones siguen una propiedad llamada espín, que puede ser ±1/2. Según el principio de exclusión, dos fermiones con el mismo espín no pueden ocupar el mismo estado cuántico en un sistema dado.
Esto significa que si dos fermiones tienen el mismo espín, no pueden existir en el mismo lugar, en el mismo momento y con los mismos valores de otras propiedades cuánticas, como la energía. Por lo tanto, esta restricción implica que los electrones en un átomo deben tener diferentes niveles de energía y ubicaciones espaciales, lo que da lugar a la estructura de capas electrónicas que caracteriza a los átomos.
El principio de exclusión de Pauli es crucial para entender la materia porque impide que los fermiones se colapsen en un solo estado cuántico, lo que daría lugar a una degeneración total. Esto significa que sin el principio de exclusión, no existirían las estructuras y propiedades únicas de la materia que observamos en el universo.
Además, el principio de exclusión de Pauli también tiene implicaciones en la estabilidad de la materia. Como los fermiones no pueden ocupar el mismo estado cuántico, esto implica que hay una fuerza repulsiva entre ellos cuando intentan acercarse demasiado. Esta fuerza repulsiva, conocida como la presión de degeneración, contrarresta la atracción gravitatoria en objetos muy densos, como las estrellas enanas blancas, evitando así su colapso gravitacional.
En resumen, el principio de exclusión de Pauli es un concepto fundamental en la física cuántica que establece que dos partículas idénticas no pueden ocupar el mismo estado cuántico al mismo tiempo. Este principio tiene un impacto significativo en la interacción y comportamiento de las partículas subatómicas, y es crucial para entender la materia en el universo.
-Principio de llenado de orbitales: ¿Cómo funciona el principio de exclusión de Pauli en relación con la configuración electrónica de los átomos?
El principio de exclusión de Pauli es una regla fundamental en la física cuántica que establece que en un átomo, ningún electrón puede tener los mismos cuatro números cuánticos. Estos números describen el estado cuántico de cada electrón, incluyendo su nivel de energía, momento angular y orientación espacial. El principio de exclusión de Pauli es crucial para entender la estructura y el comportamiento de la materia, ya que determina cómo se organizan y distribuyen los electrones alrededor del núcleo de los átomos.
Para comprender cómo funciona el principio de exclusión de Pauli en relación con la configuración electrónica de los átomos, es necesario entender primero qué son los orbitales y cómo se llenan. Los orbitales son regiones del espacio donde hay una alta probabilidad de encontrar un electrón. Cada orbital puede contener hasta dos electrones con espines opuestos, según el principio de exclusión de Pauli.
La configuración electrónica de un átomo se refiere a la distribución de los electrones en los diferentes orbitales. Según el principio de exclusión de Pauli, los electrones tienden a llenar los orbitales de menor energía primero antes de ocupar los de mayor energía. Esto se conoce como principio de llenado de orbitales.
En primer lugar, los electrones llenan los orbitales del nivel de energía más bajo (el nivel 1), antes de moverse al siguiente nivel más alto (nivel 2) y así sucesivamente. Dentro de cada nivel de energía, los electrones se distribuyen en diferentes subniveles, que se representan por letras (s, p, d, f). El subnivel más bajo (s) se llena antes que el siguiente (p), seguido por los subniveles d y f en orden ascendente de energía.
Por ejemplo, la configuración electrónica del átomo de oxígeno es 1s2 2s2 2p4. Esto significa que hay dos electrones en el orbital 1s, dos electrones en el orbital 2s y cuatro electrones en los orbitales 2p. Esta configuración satisface el principio de exclusión de Pauli, ya que ningún electrón tiene los mismos números cuánticos.
El principio de exclusión de Pauli y el principio de llenado de orbitales son cruciales para entender la química y las propiedades de los elementos. Debido a que los electrones ocupan diferentes orbitales con diferentes niveles de energía, los átomos pueden formar enlaces químicos y participar en reacciones químicas para estabilizar su configuración electrónica. Además, la distribución de los electrones en los diferentes orbitales determina las propiedades físicas y químicas de los elementos, como su conductividad eléctrica, punto de ebullición y capacidad para formar iones.
El principio de exclusión de Pauli es una regla fundamental en la física cuántica que establece que ningún electrón puede tener los mismos cuatro números cuánticos. Este principio se relaciona directamente con la configuración electrónica de los átomos y cómo se llenan los orbitales. El principio de llenado de orbitales determina el orden en el que los electrones ocupan los diferentes orbitales y subniveles de energía. Estos principios son esenciales para entender la estructura y el comportamiento de la materia, así como las propiedades de los elementos químicos.
-Relación con el electromagnetismo: ¿De qué manera se vincula el principio de exclusión de Pauli con las propiedades eléctricas y magnéticas de los materiales?
El principio de exclusión de Pauli es fundamental en la comprensión de la materia y su relación con el electromagnetismo. Este principio establece que dos electrones no pueden ocupar el mismo estado cuántico dentro de un átomo. Esto significa que no pueden tener los mismos valores para sus números cuánticos, como la energía, el momento angular y la proyección del momento angular.
Esta restricción tiene muchas implicaciones en las propiedades eléctricas y magnéticas de los materiales. Por ejemplo, debido a la presencia del principio de exclusión de Pauli, los electrones se distribuyen en diferentes niveles y subniveles de energía alrededor del núcleo atómico. Esto lleva a la formación de capas electrónicas y a la estructura de la tabla periódica de los elementos.
Cuando se aplica un campo eléctrico a un material, los electrones se ven afectados por esta fuerza y pueden moverse. Sin embargo, debido al principio de exclusión de Pauli, solo ciertos electrones con niveles de energía permitidos pueden participar en el movimiento de carga. Esto da lugar a la conductividad eléctrica en los materiales.
Además, el principio de exclusión de Pauli también tiene implicaciones en las propiedades magnéticas de los materiales. Los materiales magnéticos contienen átomos que tienen espines electrónicos desapareados, lo que significa que tienen un número impar de electrones con espines hacia arriba o hacia abajo. Estos electrones desapareados interactúan entre sí debido al principio de exclusión de Pauli y dan lugar a fenómenos magnéticos como el momento magnético y la magnetización.
El principio de exclusión de Pauli es crucial para entender las propiedades eléctricas y magnéticas de los materiales. Establece restricciones en la distribución de electrones alrededor del núcleo atómico, lo que a su vez afecta la conductividad eléctrica y las propiedades magnéticas. Sin este principio, no podríamos comprender cómo funcionan y se relacionan estos fenómenos en el mundo material.
-La importancia para la química y la física: ¿Por qué el principio de exclusión de Pauli es crucial para comprender fenómenos como la estructura atómica y la conductividad eléctrica?
El principio de exclusión de Pauli es uno de los conceptos fundamentales en la física y la química que nos permite comprender la estructura atómica y fenómenos eléctricos como la conductividad. Este principio establece que dos electrones no pueden ocupar el mismo estado cuántico dentro de un átomo simultáneamente.
Para entender mejor cómo funciona este principio, primero debemos tener en cuenta algunas nociones básicas sobre la estructura del átomo. Un átomo está compuesto por un núcleo central, formado por protones y neutrones, rodeado por una nube de electrones que se distribuyen en diferentes niveles energéticos o capas electrónicas. Cada nivel energético puede contener un número máximo de electrones, y estos se organizan en distintas subcapas y orbitales.
Ahora bien, según el principio de exclusión de Pauli, ningún par de electrones dentro de un mismo átomo puede tener los mismos valores de los cuatro números cuánticos principales: el número cuántico principal (n), el número cuántico azimutal (l), el número cuántico magnético (m) y el número cuántico de espín (s). Estos números cuánticos describen las características energéticas, geométricas y magnéticas de los electrones.
No hay dos electrones iguales
Por ejemplo, para un nivel energético determinado, tenemos subcapas representadas por las letras s, p, d y f, donde cada subcapa tiene diferentes orbitales disponibles. En la subcapa s, solo hay un orbital posible; en la subcapa p, hay tres, en la subcapa d, hay cinco; y en la subcapa f, hay siete. Cada orbital tiene capacidad para alojar un máximo de dos electrones con los mismos números cuánticos.
Supongamos que tenemos el nivel de energía n=2, que contiene la subcapa s y p. El orbital s puede contener un máximo de 2 electrones, mientras que cada orbital p puede albergar un máximo de 6 electrones (3 orbitales x 2 electrones). Sin embargo, ninguno de estos electrones puede tener los mismos números cuánticos. Por ejemplo, si un electrón ocupa el orbital 2s con n=2, l=0, m=0 y s=1/2, entonces el segundo electrón debe ubicarse en uno de los orbitales 2px, 2py o 2pz con los números cuánticos apropiados.
En términos más generales, podemos decir que esto se aplica a cualquier par de electrones dentro de un átomo. Incluso si están en diferentes niveles energéticos o capas electrónicas, deben tener diferentes valores de número cuántico en al menos uno de los cuatro números cuánticos principales.
Efectos en las propiedades químicas y físicas
La existencia del principio de exclusión de Pauli tiene importantes implicaciones en las propiedades químicas y físicas de los materiales. En primer lugar, este principio es responsable de la estabilidad de los átomos y de la formación de las diferentes configuraciones electrónicas posibles. Gracias a esta exclusión, evitamos que todos los electrones se acumulen en un solo nivel energético y, en cambio, se distribuyen de manera ordenada en diferentes niveles y subniveles.
Además, el principio de exclusión de Pauli también juega un papel crucial en la comprensión de la conductividad eléctrica de los materiales. En sustancias conductoras, como los metales, los electrones tienen una mayor movilidad y pueden moverse a través de la estructura cristalina, generando corriente eléctrica. Sin embargo, debido a este principio, los electrones deben ocupar diferentes estados cuánticos, lo que limita su capacidad de movimiento y afecta la conductividad eléctrica del material. Esto explica por qué algunos materiales son buenos conductores mientras que otros son aislantes.
El principio de exclusión de Pauli establece que dos electrones no pueden ocupar el mismo estado cuántico dentro de un átomo simultáneamente. Este principio es fundamental para comprender la estructura atómica y fenómenos como la conductividad eléctrica. Gracias a esta exclusión, los electrones se distribuyen ordenadamente en diferentes niveles y subniveles, lo que determina las propiedades químicas y físicas de los materiales. Es un concepto central en la física y la química, y su comprensión es esencial para avanzar en nuestro conocimiento sobre la materia.
-Uso en ciencias modernas: ¿En qué áreas de investigación, como la teoría de la superconductividad o la física nuclear, se aplica el principio de exclusión de Pauli?
El principio de exclusión de Pauli es fundamental en varias áreas de investigación en ciencias modernas, especialmente en campos como la teoría de la superconductividad y la física nuclear.
En el campo de la superconductividad, que estudia la conductividad eléctrica sin resistencia en ciertos materiales a bajas temperaturas, el principio de exclusión de Pauli juega un papel crucial en la comprensión de las propiedades electromagnéticas de los superconductores. La superconductividad se basa en la formación de pares de electrones llamados pares de Cooper, los cuales están sujetos a este principio. Debido a la naturaleza fermiónica (partículas con espín semi-entero) de los electrones, solo un par de ellos puede ocupar el mismo estado cuántico simultáneamente, y por lo tanto, esta característica impide la colisión de electrones en un estado de energía determinado. Esto hace que los electrones superconductores puedan fluir a través del material sin resistencia, lo que resulta en corrientes eléctricas sin pérdidas de energía.
En el ámbito de la física nuclear, el principio de exclusión de Pauli también desempeña un papel central. En la estructura de los núcleos atómicos, los protones y neutrones están sujetos a este principio. Dado que los nucleones son fermiones, están sujetos a las mismas reglas de exclusión cuántica que los electrones. Esto significa que no pueden ocupar los mismos estados de energía en el núcleo atómico. El principio de exclusión de Pauli limita el número máximo de nucleones en un determinado estado cuántico, evitando colisiones y manteniendo la estabilidad y orden en los núcleos atómicos. Sin este principio, los núcleos serían inestables y se desintegrarían fácilmente.
El principio de exclusión de Pauli es esencial para el entendimiento y desarrollo de la materia en varias áreas de investigación científica moderna, como la teoría de la superconductividad y la física nuclear. Su aplicación práctica permite comprender fenómenos fundamentales y avanzar en el conocimiento de la física de partículas y materiales.
-Retos y futuro: ¿Qué retos enfrentan los científicos al intentar comprender mejor este principio y cómo podría evolucionar nuestra comprensión en el futuro?
El principio de exclusión de Pauli es uno de los conceptos fundamentales en la física cuántica. Aunque ha sido ampliamente aceptado y utilizado por décadas, sigue siendo un desafío para los científicos comprender completamente su naturaleza y aplicaciones. El estudio continuo de este principio abre nuevas puertas para nuestra comprensión de la materia y tiene implicaciones importantes en una amplia gama de disciplinas científicas.
Reto 1: Naturaleza cuántica y comportamiento de partículas
Uno de los principales desafíos que enfrentan los científicos al intentar comprender mejor el principio de exclusión de Pauli es la naturaleza cuántica de las partículas subatómicas. Las partículas en el nivel cuántico se comportan de manera sorprendente y a menudo contradicen lo que entendemos intuitivamente sobre el mundo macroscópico. Esto hace que sea difícil visualizar y comprender plenamente cómo interactúan estas partículas y cómo opera el principio de exclusión de Pauli en estos sistemas complejos.
Reto 2: Materia condensada y sistemas en equilibrio
Otro gran reto para los científicos es entender cómo el principio de exclusión de Pauli se aplica en sistemas en equilibrio, como la materia condensada. En estos sistemas, las partículas están fuertemente acopladas y sus funciones de onda se solapan significativamente. Esto genera interacciones más complejas y comportamientos emergentes que van más allá de la simple aplicación del principio de exclusión de Pauli. Comprender cómo se relaciona este principio con otros fenómenos de la física de la materia condensada es esencial para avanzar en nuestra comprensión de estos sistemas y abrir nuevas posibilidades tecnológicas.
Reto 3: Relación con otras interacciones fundamentales
El principio de exclusión de Pauli también plantea desafíos al tratar de integrarlo y relacionarlo con otras interacciones y principios fundamentales de la física, como la fuerza electromagnética o las interacciones nucleares. Estas interacciones pueden afectar la estructura electrónica de los átomos y moléculas, así como el comportamiento de las partículas subatómicas en general. Comprender cómo se combinan estas interacciones y cómo se manifiestan en diferentes situaciones es esencial para desarrollar una teoría unificada que abarque todas las características fundamentales de la materia y la naturaleza.
Futuro de la comprensión del principio de exclusión de Pauli
A pesar de los desafíos actuales, hay razones para ser optimistas sobre el futuro de nuestra comprensión del principio de exclusión de Pauli. La continua investigación, utilizando herramientas teóricas y experimentales avanzadas, está llevando a nuevos avances en nuestro conocimiento de la física cuántica y su aplicación práctica.
Se espera que futuros experimentos y teorías nos permitan comprender mejor la aplicabilidad del principio de exclusión de Pauli en diferentes sistemas, desde partículas subatómicas hasta la estructura electrónica de materiales complejos. Esto podría conducir a nuevos desarrollos tecnológicos, como materiales superconductores que operen a temperaturas más altas o dispositivos electrónicos más eficientes.
Además, el estudio del principio de exclusión de Pauli puede ayudarnos a abordar preguntas fundamentales sobre la naturaleza misma del universo y la estructura de la materia. La comprensión más profunda de este principio podría proporcionar pistas importantes sobre fenómenos físicos aún no descubiertos y abrir nuevas puertas para exploraciones futuras en ciencia fundamental.
Los retos que enfrentamos al tratar de comprender mejor el principio de exclusión de Pauli son significativos, pero no insuperables. Con un enfoque multidisciplinario y tecnologías cada vez más avanzadas, estamos en camino de desentrañar las complejidades de este principio y aprovechar su potencial para avanzar en nuestra comprensión del mundo cuántico y la materia en general.
-Impacto en las teorías fundamentales: ¿Cómo ha influido el principio de exclusión de Pauli en la formulación de las teorías cuánticas y en la base del conocimiento científico actual?
El principio de exclusión de Pauli, formulado por el físico austriaco Wolfgang Pauli en 1925, es uno de los principios fundamentales de la mecánica cuántica. Este principio establece que dos fermiones idénticos, como electrones o quarks, no pueden ocupar el mismo estado cuántico simultáneamente dentro de un sistema. En otras palabras, ningún par de fermiones puede tener los mismos valores de todos sus números cuánticos, como la energía, el momento angular y la carga eléctrica.
Este principio tiene una gran relevancia tanto en teorías cuánticas específicas, como la mecánica cuántica y la electrodinámica cuántica, como en las teorías fundamentales que buscan unificar todas las fuerzas de la naturaleza, como la teoría de cuerdas y la teoría de campos cuánticos.
En la mecánica cuántica, el principio de exclusión de Pauli se utiliza para explicar la estructura de los átomos y la formación de los niveles de energía en los orbitales de los electrones. Por ejemplo, en el caso del átomo de hidrógeno, el principio de exclusión de Pauli establece que solo puede haber un electrón en cada orbital y, además, estos deben tener diferentes espines. Esto implica que los electrones deben distribuirse en orbitales diferentes según su nivel de energía y espín.
En la electrodinámica cuántica, el principio de exclusión de Pauli se aplica en la descripción de partículas elementales cargadas, como los electrones y los quarks, y en las interacciones electrón-electrón y quark-quark. Sin este principio, las partículas podrían colapsar en el mismo estado cuántico, lo que llevaría a resultados físicos no consistentes. Por lo tanto, el principio de exclusión de Pauli actúa como una restricción crucial para la construcción de teorías cuánticas coherentes.
En cuanto a las teorías fundamentales, como la teoría de cuerdas y la teoría de campos cuánticos, el principio de exclusión de Pauli también juega un papel fundamental. Estas teorías buscan unificar todas las fuerzas conocidas y explicar todos los fenómenos físicos en una sola estructura matemática. Para lograr esto, es necesario tener en cuenta el principio de exclusión de Pauli al describir las propiedades de las partículas y sus interacciones.
Además del impacto en las teorías fundamentales y específicas, el principio de exclusión de Pauli es crucial para entender la materia tal como la conocemos. Debido a este principio, los átomos pueden formar enlaces químicos estables y crear moléculas con propiedades únicas. Si el principio de exclusión de Pauli no existiera, la materia tendría comportamientos totalmente diferentes y no sería posible la vida tal como la conocemos.
El principio de exclusión de Pauli es un pilar fundamental de la física cuántica y tiene una gran influencia tanto en las teorías fundamentales como en las teorías específicas. Este principio permite entender la estructura de los átomos, la formación de niveles de energía y la estabilidad de las moléculas. Además, su aplicación es crucial en la unificación de todas las fuerzas conocidas y en la búsqueda de una teoría que explique todos los fenómenos físicos en una sola estructura matemática.
Preguntas frecuentes (FAQ)
1. ¿Qué es el principio de exclusión de Pauli?
El principio de exclusión de Pauli establece que dos electrones no pueden ocupar el mismo estado cuántico en un átomo al mismo tiempo.
2. ¿Por qué es importante el principio de exclusión de Pauli?
Es crucial porque gracias a este principio se explican propiedades fundamentales de la materia, como la estabilidad de los átomos y la formación de enlaces químicos.
3. ¿Cómo funciona el principio de exclusión de Pauli?
Cuando un átomo tiene varios electrones, cada uno debe ocupar una posición diferente en cuanto a su energía y arreglo espacial, lo que garantiza que no se superpongan los estados cuánticos.
4. ¿Cuál es la consecuencia del principio de exclusión de Pauli?
La principal consecuencia es que cada orbital atómico puede contener máximo dos electrones con espines opuestos.
5. ¿Quién descubrió el principio de exclusión de Pauli?
Fue descubierto por el físico austriaco Wolfgang Pauli en 1925, quien recibió el Premio Nobel de Física en 1945 por sus contribuciones a esta teoría.
Deja una respuesta
Entradas relacionadas